Contáctanos y te enviaremos un presupuesto de ensayo clínico en 48 horas.
Haz clic aquí para descargar un presupuesto de ensayo clínico completo en PDF
Las empresas de biotecnología y farmacéuticas necesitan conocer el coste de un ensayo clínico para planificar la financiación de sus programas de desarrollo de fármacos.
En particular, las empresas de biotecnología que buscan que sus fármacos candidatos sean aprobados por la Food and Drug Administration (FDA) o European Medicines Agency (EMA) deben ser conscientes del coste de realizar ensayos clínicos en hospitales americanos y europeos.
Sin embargo, a pesar de la importancia fundamental de conocer el precio de los ensayos clínicos, las empresas de biotecnología que se encuentran en las primeras etapas del desarrollo de medicamentos pueden tener dificultades para tener una idea clara de todos los costes involucrados en un estudio clínico.
Las organizaciones de investigación clínica por contrato (CRO) son empresas especializadas en la gestión de ensayos clínicos de principio a fin, y pueden proporcionar cotizaciones detalladas de ensayos clínicos a empresas de biotecnología, incluidos todos los gastos involucrados en un estudio de fase I, II o III.
Por lo tanto, los gerentes o encargados de operaciones de las empresas biotecnológicas pueden obtener apoyo de las CRO para calcular cuánto costarán sus ensayos clínicos, incluidos los servicios de CRO y las tarifas de terceras partes (otros proveedores necesarios).
Este artículo pretende ayudar a los directores ejecutivos, de operaciones y financieros de biotecnológicas a comprender los costes reales involucrados en la ejecución de un ensayo clínico.
Si deseas recibir un presupuesto de ensayo clínico rápido ahora por correo electrónico, comunícate con nosotros aquí.
¿Qué es una organización de investigación por contrato (CRO)?
Si necesitas una cotización de ensayo clínico, una organización de investigación por contrato (CRO) es el tipo de empresa que puede ayudarte.
Una CRO es una empresa dedicada a gestionar ensayos clínicos y se encarga de todas o varias de las tareas involucradas en un estudio clínico, incluidos asuntos regulatorios, selección de centros, monitorización in situ, gestión de datos, bioestadística y redacción médica, entre otros.
Dado que las CROs tienen una visión global de todas las etapas y elementos de un estudio clínico, pueden proporcionar presupuestos detallados de todos los gastos del ensayo clínico.
¿Qué cuesta realizar un ensayo clínico?
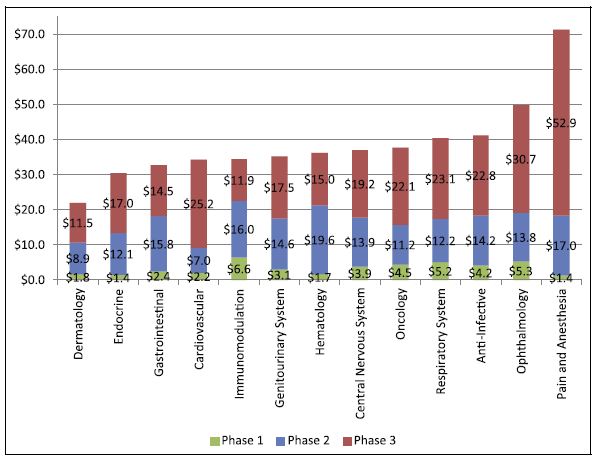
Los costes de los ensayos clínicos de fase 1, 2 y 3 realizados en los Estados Unidos están en el rango de 1,4-6,6, 7,0-19,6 y 11,5-52,9 millones de dólares US, respectivamente.
Estos números fueron calculados por Aylin Sertkaya et al. en su excelente artículo sobre los principales factores de coste de los ensayos clínicos farmacéuticos en los Estados Unidos [1].
Es importante resaltar que el precio de un ensayo clínico en los Estados Unidos suele ser bastante mayor a los costes de realizarlo en Europa, y particularmente en España.
En cualquier caso, estimar el precio real de un estudio clínico no es fácil dados los diversos factores involucrados.
Analicemos estos factores.
¿Cuáles son los factores de coste principales en un ensayo clínico?
El coste total de un ensayo clínico depende de muchas variables, pero los principales factores de coste son:
(1) el número de participantes (pacientes), y
(2) la complejidad del protocolo del ensayo clínico.
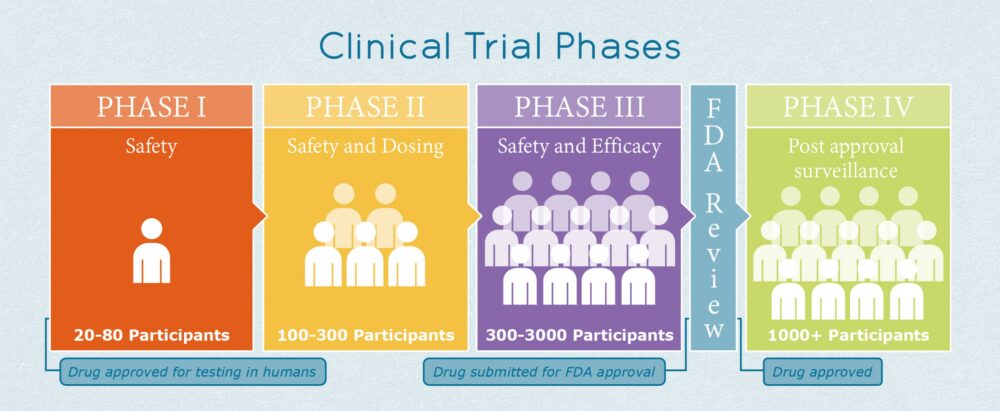
En primer lugar, el número de participantes en un ensayo clínico está muy relacionado con la fase de estudio.
Por ejemplo, los ensayos clínicos de fase 1, que se centran en evaluar la seguridad de los medicamentos, reclutan un promedio de 20 a 80 pacientes.
Los ensayos de fase 2 —que analizan la seguridad, la dosis y la eficacia preliminar— normalmente incluyen entre 100 y 300 participantes.
Los ensayos clínicos de fase 3, de etapa posterior, son estudios más grandes que evalúan la seguridad y la eficacia y pueden reclutar muchos pacientes según el área terapéutica (entre 300 y 3000 participantes), como se muestra en la Figura 1 a continuación.
Figura 1: Fases de un ensayo clínico[2]
El número de participantes en un ensayo clínico es un factor de coste global clave porque cada paciente reclutado implica un dinero que el promotor del estudio debe pagar al hospital para cubrir los exámenes y procedimientos médicos.
En segundo lugar, la complejidad del protocolo del ensayo clínico también tiene un impacto directo en el coste del estudio.
Por ejemplo, un tratamiento oncológico largo y complejo, que puede incluir varios ciclos de administración de fármacos por vía intravenosa hasta la progresión de la enfermedad, implicará varias visitas de pacientes a los centros, con las pruebas clínicas correspondientes (p. ej., TACs, ECG), que aumentarán significativamente los gastos del estudio.
Por otro lado, un estudio clínico simple y corto con pocas visitas usando un medicamento oral puede incluir menos visitas y pruebas por protocolo, lo que reducirá la factura del centro.
Por tanto, la complejidad clínica y la duración de un ensayo juegan un papel decisivo en el precio de un estudio clínico.
Además, existen otros factores de coste de los ensayos clínicos, como las herramientas y aplicaciones tecnológicas que se utilizarán, el número de proveedores externos necesarios (por ejemplo, laboratorios centrales y distribuidoras de medicamentos) y los países en los que se lleva a cabo la investigación.
¿Es más caro realizar un ensayo clínico en los Estados Unidos que hacerlo en otras partes del mundo?
En general sí. La realización de un ensayo clínico en los Estados Unidos de América implica mayores costes en comparación con la realización de un estudio en otros países (por ejemplo, Europa o Asia).
¿Cuánto cuestan los ensayos clínicos de fase 1?
El coste promedio de un estudio de fase 1 realizado en un hospital de los Estados Unidos oscila entre 1,4 y 6,6 millones de dólares US, incluidos los gastos generales estimados del hospital y los costes de monitorización [1].
¿Cuánto cuestan los ensayos clínicos de fase 2?
Un estudio de fase 2 en los Estados Unidos cuesta entre 7,0 millones (cardiovascular) y 19,6 millones de dólares (hematología) [1].
¿Cuánto cuestan los ensayos clínicos de fase 3?
Los ensayos clínicos de fase 3 en los Estados Unidos (muchos de ellos considerados “pivotales”) oscilan entre los 11,5 y los 52,9 millones de dólares [1].
Figura 2: Costes de ensayos clínicos por fase y área terapéutica [1]
En otro estudio realizado por Thomas J. Moore et al [3], el coste estimado de los ensayos clínicos pivotales que respaldaron la aprobación de la FDA de 101 medicamentos aprobados tuvo una mediana de 48 millones (IQR entre 20 y 102 millones US).
Cada ensayo pivotal individual costó una mediana de 19 millones de dólares US (IQR entre 12 y 33 millones).
El coste estimado por paciente fue de 41.413 dólares US (IQR 29.894 – 75.047 dólares), y cada visita de un paciente al hospital del estudio tuvo un coste medio estimado de 3.685 dólares US (IQR 2.640 – 5.498 dólares).
¿Cómo estructuran normalmente las CROs un presupuesto de ensayo clínico?
Las CRO estructuran sus cotizaciones de diferentes maneras, pero normalmente dividen sus presupuestos en dos categorías principales: (1) servicios de CRO y (2) costes de terceras partes (otros proveedores).
La categoría de servicio CRO generalmente incluye conceptos como:
- Asuntos regulatorios
- Identificación y selección de los hospitales
- Contratación y pagos a los hospitales
- Inicio y activación de los hospitales
- Gestión de centros
- Monitorización presencial
- Gestión de la seguridad de los medicamentos
- Logística de medicamentos
- Logística de muestras biológicas
- Logística de suministros clínicos
- Redacción médica
- Cierre del centro
- Gestión del proyecto
- Gestión de documentos
- Gestión de datos
- Programación estadística
- Control de calidad
La categoría de costes de terceras partes (otros proveedores) normalmente incluye los siguientes elementos:
- Costes de envío
- Suministros clínicos
- Material de oficina
- Tarifa por paciente a pagar al hospital
- Tasas de publicaciones
- Tasa de evaluación de la agencia reguladora / comité de ética
- Tasas de gestión del contrato por parte de los hospitales
- Gastos de viajes
- Servicios de distribución de medicamentos
- Servicios de laboratorios centrales
- Sistema CRDe para la recogida de datos
- Sistema IRT para la gestión de medicamentos
- Plataformas de imágenes radiológicas
- Electronic Trial Master File (eTMF)
- Plataforma de seguridad de medicamentos
¿Cuáles son los elementos más costosos en un presupuesto de ensayo clínico de CRO?
Los elementos más costosos en un presupuesto de ensayo clínico son la gestión de los centros y los costes de gestión del proyecto (servicios directos de CRO).
Además, el gasto de otros proveedores más importante es la tarifa que se debe pagar a los hospitales por cada paciente reclutado (es decir, los costes de los procedimientos y pruebas clínicas).
¿Cuánto cobran los hospitales por cada paciente tratado en un ensayo clínico?
La cantidad de dinero que debe pagar el promotor a los hospitales en los que se tratan los pacientes —para cubrir procedimientos y pruebas médicas— varía según el tipo de estudio, pero en los Estados Unidos puede ir desde 20.000 hasta 70.000 dólares US por paciente. En España puede ser a partir de 4.000 € por paciente dependiendo del tipo de estudio.
¿Cuánto cuesta un cuaderno de recogida de datos electrónico (CRDe)?
En un ensayo clínico, un cuaderno de recogida de datos electrónico (CRDe) es una herramienta que utilizan los hospitales para introducir datos clínicos.
El coste de un software CRDe —precio de licencia y hosting— está en el rango de 1.000 y 5.000 € por mes de uso, dependiendo del tipo de solución.
Este precio no incluye los servicios iniciales necesarios para diseñar, documentar, implementar, probar y validar la herramienta CRDe.
Lee el siguiente artículo para obtener más información sobre los costes del software CRDe:
How Much Does an Electronic Case Report Form (eCRF) Cost?
¿Cuánto cuesta fabricar un medicamento para un ensayo clínico?
La respuesta a esta pregunta depende de muchos factores, pero por lo general la fabricación de un lote de medicamentos para un ensayo clínico puede estar en el rango promedio de 300.000 a 1 millón de euros.
Esto no incluye el coste de producción de la sustancia farmacéutica o el ingrediente farmacéutico activo (API).
Lee el siguiente artículo para obtener más información sobre los costes de fabricación de medicamentos en el contexto de los ensayos clínicos:
How Much Does it Cost to Manufacture a Drug for a Clinical Trial?
¿Cuánto cuesta empaquetar, etiquetar, almacenar y distribuir un medicamento en un ensayo clínico?
El coste de empaquetar, etiquetar, almacenar y distribuir un medicamento en un ensayo clínico puede oscilar entre 40.000 y 100.000 € por estudio.
El coste de gestionar los medicamentos en un ensayo clínico depende de la cantidad de medicamento necesaria, el número de hospitales, las condiciones de temperatura, la cantidad de envíos desde el fabricante a la empresa distribuidora y la cantidad de envíos desde la distribuidora a los centros.
Lee el siguiente artículo para obtener más información sobre los costes de empaquetado, etiquetado, almacenamiento y distribución de medicamentos en el contexto de los ensayos clínicos:
What is the Cost of Packaging, Labeling, Storing, and Distributing Drugs in a Clinical Trial?
Conclusión
Los costes de los ensayos clínicos de fase 1, 2 y 3 realizados en los Estados Unidos están en el rango de 1,4-6,6, 7,0-19,6 y 11,5-52,9 millones US, respectivamente.
El precio de un ensayo realizado en Europa (p. ej. España) puede ser bastante más bajo.
Una CRO puede ayudarte a realizar un cálculo más preciso para tu ensayo clínico específico.
Comunícate con nosotros y te enviaremos una cotización aproximada de tu ensayo clínico en un plazo de 48 horas. Te podemos enviar un presupuesto adaptado para Estados Unidos, Europa, y España.
Haz clic aquí si deseas descargar un presupuesto completo de ensayo clínico en PDF
Referencias: