Europa, junto a los Estados Unidos y Asia, es una de las regiones del mundo donde más ensayos clínicos se realizan.
Actualmente en la base de datos norteamericana Clinicaltrials.gov, hay registrados 65.572 ensayos clínicos en Europa, el 22,13% de los cuales son para tratamientos contra el cáncer (14.509 ensayos).
¿Cuáles son los motivos que hacen que se realicen tantos ensayos clínicos en Europa? ¿Qué ventajas ofrecen los países europeos?
Te lo explicamos a continuación.
1. Gran experiencia en ensayos clínicos
Gracias a que se realiza un número tan elevado de ensayos clínicos en Europa, los profesionales implicados en estos estudios disponen de una amplia experiencia en investigación clínica.
Esto permite que los ensayos clínicos realizados sean de alta calidad.
Si quieres más información sobre cuáles son los aspectos básicos de calidad que deben cumplir los ensayos, encontrarás más información en este artículo: Cómo llevar a cabo ensayos clínicos de alta calidad.
La gran mayoría de los ensayos clínicos se realizan en:
- Francia (16549)
- Alemania (14743)
- Reino Unido (13715)
- España (10008)
- Italia (9643)
En la siguiente imagen puedes observar el número de ensayos clínicos llevados a cabo en cada país europeo (Fuente: https://ClinicalTrials.gov. Datos obtenidos el 07/03/2019):

![]()
2. Inversión de compañías farmacéuticas internacionales
También es importante destacar que en los últimos años el interés de las compañías farmacéuticas internacionales en realizar ensayos clínicos en algunos países europeos (como España) ha aumentado.
En el siguiente vídeo puedes ver una reciente noticia en la que se destacan las buenas condiciones de este país para realizar proyectos internacionales de I+D biomédica y cómo ha aumentado la inversión en ensayos clínicos por parte de las compañías farmacéuticas: hace 15 años se invirtieron 299 millones de euros y en 2017 se llegaron a registrar 662 millones.
3. Ensayos en enfermedades raras y Redes Europeas de Referencia (RER)
Una de las ventajas de realizar un estudio clínico en Europa es que existen iniciativas y políticas que promueven la investigación en medicamentos huérfanos y enfermedades raras mediante incentivos económicos y otros beneficios.
Por tanto, si tu investigación está relacionada con alguna de estas áreas terapéuticas, podrías beneficiarte de esta situación.
Además, se han creado redes europeas de referencia (RER) en enfermedades y trastornos complejos o raros que requieren un tratamiento altamente especializado y unos conocimientos y recursos muy específicos.
Estas redes facilitan el diagnóstico y el tratamiento de los pacientes con este tipo de patologías, así como su reclutamiento para ensayos clínicos.
Un ejemplo de esto lo encontramos en ERN EURACAN, la red europea de referencia en cánceres de adulto (tumores sólidos) que ayuda a los pacientes con cánceres raros, es decir, aquellos tumores que afectan a menos de 6 personas de cada 100.000 por año.
EURACAN clasifica los cánceres raros en 10 dominios siguiendo la décima revisión de la Clasificación Estadística Internacional de Enfermedades y Problemas Relacionados con la Salud (ICD10), a RARECARE y a los proyectos de RARECARENet, y éstos en subdominios.
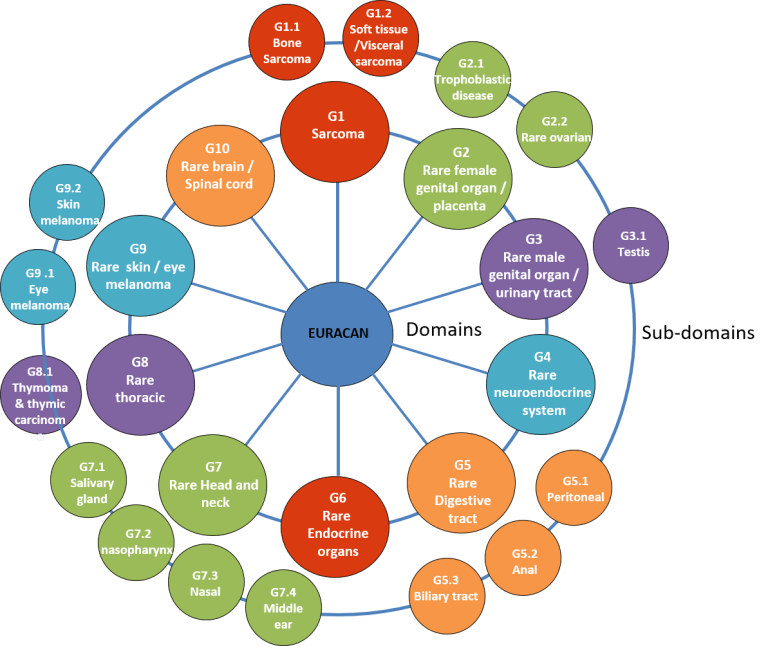
Esta división facilita el diagnóstico, tratamiento e investigación de estos tumores, ya que permite acceder rápidamente a los hospitales e investigadores especializados en determinados subtipos de tumores y agilizar los ensayos clínicos.
Si quieres saber más sobre este tema, en este artículo encontrarás información relacionada con los ensayos clínicos en cánceres raros: 10 Things You Should Know About Rare Cancers and Clinical Trials.
4. El papel de los grupos cooperativos de investigación académica
Otro factor que puede ayudar a los promotores a organizar y llevar a cabo un estudio clínico en Europa es la presencia de diversos grupos cooperativos de investigación académica en cáncer sin ánimo de lucro.
En España, como ejemplo específico, existen diversos grupos cooperativos de investigación en cáncer y puedes aprender más acerca de ellos en este dossier de la Sociedad Española de Oncología Médica (SEOM).
Estos grupos cooperativos son organizaciones formadas por oncólogos y otros profesionales especializados en cáncer cuyo objetivo es fomentar la investigación en oncología médica, con un enfoque multidisciplinar, en un tipo tumoral concreto para mejorar la prevención y tratamiento de los pacientes afectados.
La dilatada experiencia de los especialistas participantes en estos grupos de investigación, que hace más de 20 años que se crearon en España, facilita que el desarrollo de los estudios y ensayos clínicos con nuevas terapias contra el cáncer se haga de manera óptima.
Gracias a ellos, tanto la selección de los hospitales participantes como el reclutamiento de pacientes y el inicio del ensayo de tu estudio pueden realizarse de manera más rápida.
También están fuertemente implicados en la divulgación de los conocimientos obtenidos. Por ejemplo, colaboran en la creación de guías para establecer pautas estandarizadas de diagnóstico y tratamiento que puedan ser utilizadas en la práctica clínica.
Estos grupos colaboran estrechamente con grupos cooperativos internacionales para poder realizar estudios más amplios y lograr mejores resultados, creándose así una gran red de conocimiento internacional en la que los equipos de investigación europeos juegan un papel clave.
Por ejemplo, en el World Sarcoma Network, colaboran, entre otros, los siguientes grupos europeos:
- Grupo Español de Investigación en Sarcomas (GEIS)
- Scandinavian Sarcoma Group (SSG)
- Italian Sarcoma Group (ISG)
- French Sarcoma Group (GSF-GETO)
- German Sarcoma Study Group (GISG)
En el caso del European Network of Gynecologic Trials (ENGOT), entre sus grupos participantes encontramos:
- Grupo Español de Investigación en Cáncer de Ovario (GEICO)
- Multicenter Italian Trials in Ovarian Cancer (MITO)
- Belgium and Luxembourg Gynaecological Oncology Group (BGOG)
- Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe (AGO)
- Groupe d’Investigateurs Nationaux pour l’Etude des Cancers Ovariens (GINECO)
- Nordic Society for Ginecologic Oncology (NSGO)
5. La legislación de la investigación clínica en Europa
Otra de las principales ventajas de Europa para llevar a cabo ensayos clínicos es la legislación que los regula, ya que ésta permite realizarlos de manera rápida y fácil.
Gracias al reglamento sobre ensayos clínicos de medicamentos de uso humano (Reglamento (UE) Nº 536/2014), que entró en vigor el 28 de mayo de 2016, las reglas necesarias para realizar ensayos clínicos son las mismas en toda la Unión Europea.
El hecho de que la regulación esté unificada en tantos países permite reclutar el número deseado de pacientes realizando menos trámites burocráticos. Por tanto, facilita y agiliza la realización de ensayos clínicos internacionales.
El tiempo medio necesario para la aprobación de nuevos ensayos clínicos es de unos 60-90 días. En este artículo puedes encontrar más información sobre la situación actual en España: Spain Accelerates Clinical Trial Timelines.
Además de simplificar los procedimientos necesarios, otro de los objetivos principales de este reglamento es aumentar la transparencia de los ensayos clínicos para garantizar la calidad de los resultados obtenidos.
Si quieres saber detalladamente cómo llevar a cabo un ensayo clínico en oncología en un país europeo, te recomendamos que descargues nuestra guía de manera gratuita: What do you need to carry out a cancer clinical trial in Spain?

6. Bioética: Normas de Buena Práctica Clínica (BPC)
Otro punto importante a tener en cuenta a la hora de elegir dónde realizar su ensayo clínico son los principios de bioética que siguen las investigaciones, ya que proteger la seguridad de los pacientes participantes es esencial.
Los ensayos clínicos realizados en Europa cumplen con las normas de Buena Práctica Clínica (BPC) de la Conferencia Internacional de Armonización (ICH).
Se trata de una norma internacional que consta de trece principios éticos y de calidad de la investigación cuyo objetivo es proteger los derechos, la seguridad y el bienestar de las personas participantes en investigaciones clínicas, como los ensayos clínicos con medicamentos y dispositivos médicos, de acuerdo con los principios de la Declaración de Helsinki.
Además, esta normativa también garantiza la fiabilidad y exactitud de los resultados obtenidos.
Gracias a que esta norma está unificada, facilita la aceptación por parte de las autoridades reguladoras de distintos países, como los de la Unión Europea, Japón y Estados Unidos, de los datos clínicos obtenidos en las investigaciones.
A diferencia de lo que ocurre en otros países, la legislación que regula los ensayos clínicos en Europa especifica que éstos deben ser diseñados, realizados y comunicados siguiendo las normas de BPC, por lo que es obligatorio que se cumplan (no es solo una recomendación).
Esto constituye un motivo más para realizar ensayos clínicos en Europa.
Si deseas leer la guía de Buena Práctica Clínica completa, puedes acceder a ella desde aquí
7. La calidad de los sistemas sanitarios y la investigación de los países europeos
También es necesario valorar la calidad de los sistemas sanitarios de los países en los que se va a realizar el ensayo clínico, ya que de ello depende en gran parte la fiabilidad de los resultados obtenidos.
La mayoría de los países europeos cuentan con sistemas sanitarios de excelente calidad.
Esto lo puedes comprobar en el siguiente mapa, en el que se muestra el Índice de Acceso y Calidad en el Cuidado de la Salud (HAQ, por sus siglas en inglés) de cada país en el año 2016.
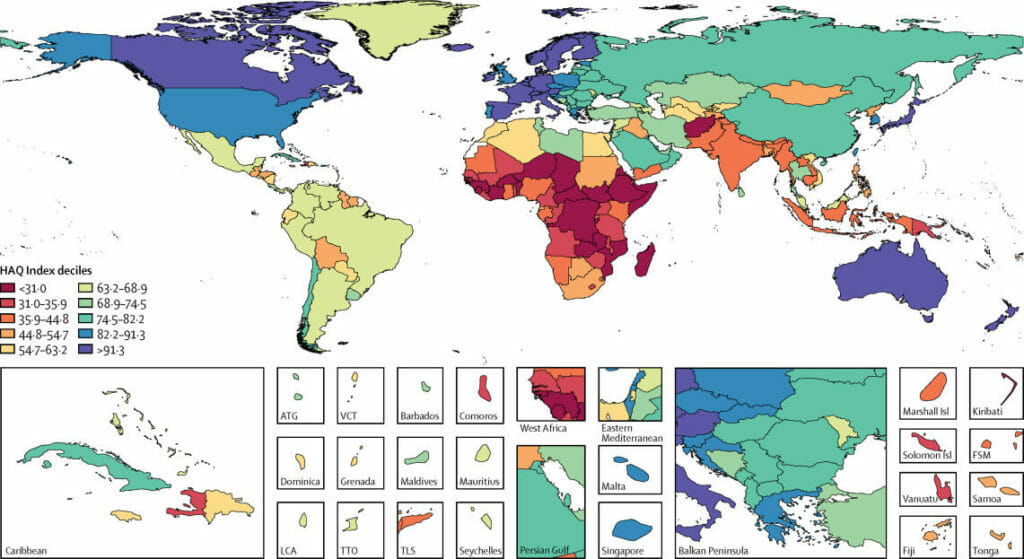
El estudio fue publicado en The Lancet y, si deseas información detallada, como el índice HAQ de cada país, puedes acceder al artículo completo desde este enlace: Measuring performance on the Healthcare Access and Quality Index for 195 countries and territories and selected subnational locations: a systematic analysis from the Global Burden of Disease Study 2016.
Gracias a la buena organización de los sistemas sanitarios y la amplia experiencia en investigación de la que disponen los profesionales de la mayoría de los países europeos, es posible realizar ensayos clínicos de alta calidad y obtener resultados totalmente fiables.
Esta característica también facilita el reclutamiento de pacientes para los estudios clínicos.
Conclusión: ¿Por qué Europa es un buen lugar para realizar ensayos clínicos?
Como hemos visto en este artículo, Europa es un territorio muy interesante a considerar para desarrollar un ensayo clínico. Los principales motivos son:
- Los profesionales implicados en la investigación clínica cuentan con una amplia experiencia.
- Las compañías farmacéuticas internacionales cada vez invierten más dinero en ensayos clínicos en estos países gracias a sus buenas condiciones.
- Se están dedicando muchos recursos al estudio de enfermedades raras, como los cánceres raros, y gracias a las redes europeas de referencia es más fácil el reclutamiento de pacientes.
- Existen grupos cooperativos de investigación académica en cáncer que fomentan la investigación en oncología médica.
- Agilidad y transparencia en los trámites burocráticos necesarios para llevar a cabo su investigación gracias a la legislación que los regula.
- Las normas de Buena Práctica Clínica garantizan que en los ensayos clínicos se proteja la seguridad, el bienestar y los derechos de los participantes y que los resultados sean fiables.
- Europa cuenta con sistemas sanitarios de calidad, lo que ayuda a obtener resultados fiables.
Por todas estas razones creemos que deberías considerar Europa para llevar a cabo tu ensayo clínico.
Si deseas más información sobre las ventajas de realizar su ensayo clínico de oncología en España en concreto, te recomendamos que descargues nuestra guía gratis en el siguiente enlace: Nine reasons to conduct an oncology trial in Spain.

En Sofpromed podemos ayudarte a llevar a cabo tu ensayo clínico en Europa. Si tienes alguna duda relacionada sobre cómo realizar tu ensayo clínico, puedes escribirnos un comentario aquí o contactar con nosotros en info@sofpromed.com.